
2020年9月19日上午,我院伦理委员会在门诊5楼科教培训中心召开九月份伦理审查会议,对9月份我院眼科、肾内科、肿瘤诊疗中心、消化内科申请的五个药物临床试验项目进行伦理审查。副院长李甦雁等项目主要研究者作伦理报告。伦委会主委赵玉良主持会议,伦委会委员、秘书、申办方、CRA、独立技术顾问等参加会议。


会上,伦委会秘书李莉同志首先向委员通报了近期伦理办组织的快速审查会情况,组织委员学习国家药监局(NMPA)《药物临床试验质量管理规范(2020版)》,发放机构办和伦理办编印的培训资料;伦委会办公室主任李泳同志介绍了《市一院医学伦理委员会制度与标准操作规程》(V3.0版)修订背景、修订依据、修订内容并组织委员讨论、定稿。最后,伦委会对9月份各科室申请的III-IV期药物临床试验进行伦理审查。
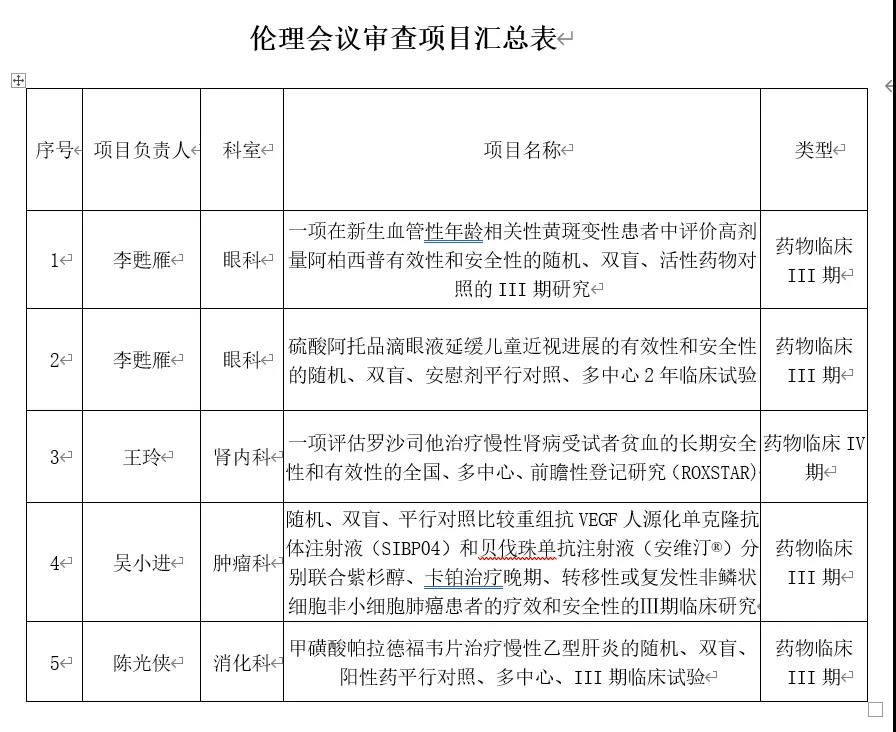
伦理会议审查项目汇总表
开展III期药物临床试验
是我院下半年重点工作之一

国家药物临床试验机构认证书
当前,我国药品医疗器械产业快速发展,创新创业方兴未艾,审评审批制度改革持续推进。但总体上看,我国药品医疗器械科技创新支撑不够,上市产品质量与国际先进水平存在差距。为促进药品医疗器械产业结构调整和技术创新,提高产业竞争力,满足公众临床需要,中共中央办公厅、国务院办公厅2017年10月8日印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,从改革临床试验管理、加快上市审评审批、促进药品创新和仿制药发展、加强药品医疗器械全生命周期管理、提升技术支撑能力、加强组织实施六个方面鼓励药品、医疗器械创新。
我院是国家药品监督管理局批准的国家药物临床试验机构。开展III期药物临床试验是下半年机构办公室工作计划中重点工作之一。III期药物临床试验是药品上市前治疗作用确证阶段,是将试验药物应用于更大范围(300例以上)的病人志愿者身上,进行“扩大的多中心临床试验”,进一步评价药物的有效性和安全性,最终为药物注册申请上市提供充分的依据。试验一般采取“多中心随机盲法对照试验”。
临床试验应符合伦理道德标准,保证受试者在自愿参与前被告知足够的试验信息,理解并签署知情同意书,保护受试者的安全、健康和权益。伦理委员会负责审查多中心研究临床试验方案的科学性、安全性和伦理合理性,在本机构实施的可行性,审核主要研究者的资质和GCP培训经历、专业科室的设备技术条件、知情同意书样本、弱势群体保护、应急预案、确定跟踪审查的时间,监督临床试验开展情况并进行伦理跟踪审查。




 苏公网安备32031102000718号
苏公网安备32031102000718号